Pomóż w opracowaniu witryny, udostępniając artykuł znajomym!
Co jest w środku? Każdy zadawał sobie to pytanie. To jedna z cech naturalnej ludzkiej ciekawości.
Zaspokajamy tę ciekawość od niemowlęctwa. Im dłużej możemy zadawać sobie to pytanie (i innym to się podoba), najlepiej do późnej starości, tym bogatsze będzie nasze życie.
Ale o co tak naprawdę pytamy? Dziecko zaglądając do wnętrza zabawki szuka przede wszystkim nowej struktury materiału. Młody człowiek, zaglądając do książki czy internetu, szuka przede wszystkim informacji – mniej interesuje go to, z czego są zrobione.Archeolog badający nowo odkopany zabytkowy obiekt poszukuje zarówno informacji, jak i struktury materiałowej – ta ostatnia również zostanie przekształcona w informację. W ten sam sposób geolog, zaglądając (przy pomocy młotka i dłuta, lupy, promieni rentgenowskich) w głąb skały, szuka tam minerałów oraz symetrii i piękna.
Czy konieczna jest zmiana struktury zewnętrznej, a nawet zniszczenie tego, co chcemy zobaczyć w środku? Na szczęście nie! W końcu lekarz zagląda do wnętrza ludzkiego ciała za pomocą całego arsenału narzędzi i narzędzi. Cenimy współczesną medycynę za jej minimalnie inwazyjną lub prawie bezinwazyjną penetrację. Nie trzeba zaglądać do środka za pomocą ludzkich zmysłów - możemy zobaczyć za pomocą ultradźwięków, promieni rentgenowskich, fal radiowych i wielu innych metod.
Czy zawsze jesteśmy gotowi na to, że musimy zajrzeć do środka? Oczywiście, że nie, rozważmy na przykład zaglądanie do nieświeżego jajka. Alchemicy często rozważali swoje mieszanki z ogniem - czasami eksplodował, ponieważ wewnątrz oprócz struktury i informacji przechowywana była energia.Zajrzenie do wnętrza jądra atomowego pozwoliło nawet przewidzieć, choć nie od razu, że „wydobędzie się z niego energia”.
Teoria - zwięzła i jasna
Pod koniec pierwszej dekady XX wieku Ernst Rutherford wraz ze swoimi kolegami Hansem Geigerem i Ernestem Marsdenem zajrzeli do wnętrza atomu. Obiekt, którego istnienie sto lat wcześniej było jedynie hipotezą, ciekawostką odziedziczoną po Demokrycie i kilku innych starożytnych myślicielach. Obiekt, który jeszcze w połowie XIX wieku uważano za nie mający nic w środku. Obiekt, który w końcu stał się tak mały, że nie można go było zobaczyć - wiadomo było tylko, że atomy raczej istnieją. Jak wyglądały wewnątrz atomu? Czego szukali? Co oni widzieli? Czy tego się spodziewali, czy może czegoś zupełnie innego? Zdecydowanie warto o tym wszystkim poczytać
 Ryż. 1. (Od lewej do prawej) Ernest Rutherford, Hans Geiger i Ernest Marsden zaprojektowali i przeprowadzili serię eksperymentów w latach 1908-1911, w których badali rozkład materii w atomie. Po zinterpretowaniu wyników opracowali planetarny model atomu.
Ryż. 1. (Od lewej do prawej) Ernest Rutherford, Hans Geiger i Ernest Marsden zaprojektowali i przeprowadzili serię eksperymentów w latach 1908-1911, w których badali rozkład materii w atomie. Po zinterpretowaniu wyników opracowali planetarny model atomu.
Wiek XIX przyniósł wiele badań naukowych na pograniczu chemii i fizyki. Obejmowało to badania nad problemem „pierwiastek kontra związek”, ilościowym aspektem reakcji chemicznych, w tym zjawiska elektrolizy, a także w dziedzinie termodynamiki i optyki. Pojawiło się pojęcie liczby Avogadro.
Wyjaśnienie zachowania się substancji w stanie lotnym było wielkim sukcesem teorii kinetyczno-molekularnej. Zakładała ziarnistą budowę materii, czyli istnienie najmniejszych cząstek materii: atomów lub ich ściśle określonych grup - cząsteczek. Jest to najczęściej cytowany przykład; na podstawie podobnych założeń wyjaśnia się także wiele innych zjawisk. Z kolei badania materii w stanie stałym pozwoliły oszacować rozmiary poszczególnych atomów (ryc. 2).
Okazało się, że niezależnie od pierwiastka wymiary te były rzędu jednego lub dwóch angstremów. Udało nam się również oszacować masy różnych atomów - okazało się, że są one powiązane z liczbą masową A pierwiastka. Atomy były znane jako elektrycznie obojętne.
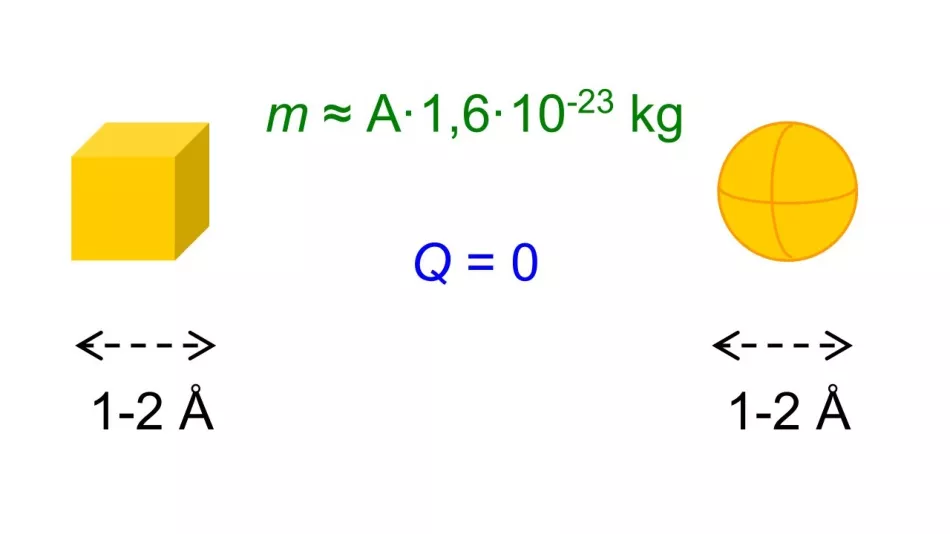 Ryż. 2. Niezależnie od tego, czy atomy były reprezentowane jako kule, sześciany czy inne kształty, znane były ich przybliżone wymiary, liczba atomowa Z i liczba masowa A, a także ich bezwładność elektryczna.
Ryż. 2. Niezależnie od tego, czy atomy były reprezentowane jako kule, sześciany czy inne kształty, znane były ich przybliżone wymiary, liczba atomowa Z i liczba masowa A, a także ich bezwładność elektryczna.
Co jest w atomie?
Nieoczekiwanym rezultatem tych badań było odkrycie wewnętrznej budowy atomów. Promienie katodowe, znane od kilkudziesięciu lat, zostały rozpoznane w pierwszej dekadzie XX wieku jako wiązki „atomów elektryczności” (dziś wiemy: elektronów) o właściwościach niezależnych od materiału, z którego są emitowane. Wniosek może być tylko jeden: elektrony są częścią każdego atomu. Jednak zarówno ich niezerowy ładunek elektryczny (dziś wiemy, że jest ujemny), jak i znana wówczas masa (o trzy do czterech rzędów wielkości mniejsza niż masa atomu) wskazywały, że atomy nadal muszą zawierać pewne składniki (ryc. 3).
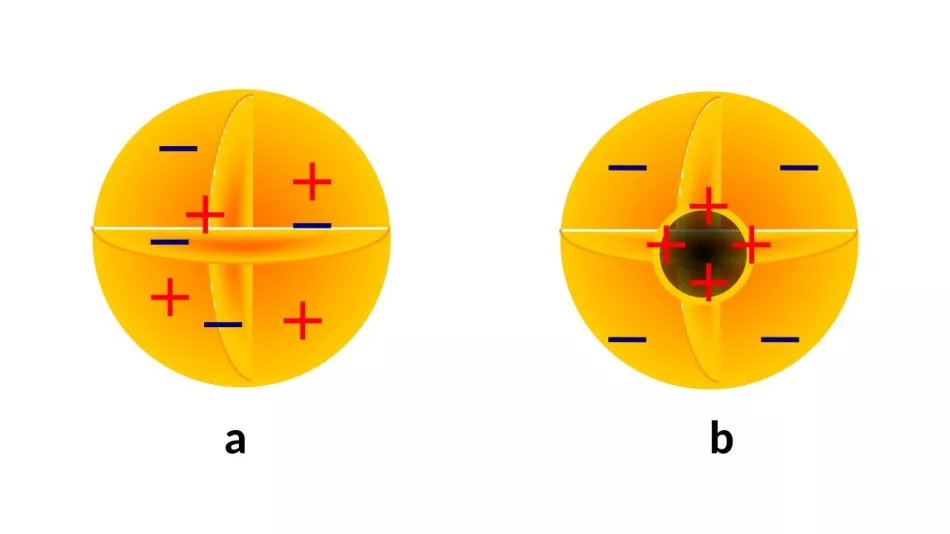 Na przełomie XIX i XX wieku opracowano kilka modeli opisujących przestrzenny rozkład materii i ładunku. Niektórzy (ryc. 2a) przewidywali równomierny rozkład materii i ładunku wewnątrz atomu.
Na przełomie XIX i XX wieku opracowano kilka modeli opisujących przestrzenny rozkład materii i ładunku. Niektórzy (ryc. 2a) przewidywali równomierny rozkład materii i ładunku wewnątrz atomu.Przeważała jednak opinia o istnieniu jądra atomowego (ryc. 2b) - dodatnio naładowanej, masywnej wewnętrznej podstruktury, z które elektrony są połączone w taki czy inny sposób, niekoniecznie symetrycznie.
Problem polegał na tym, jak elementy są ułożone wewnątrz atomu, w tym na naturze ich ewentualnego ruchu. Wysuwano różne hipotezy, chociaż dominował pogląd, że:
- masa atomu jest związana z tym, co jest w nim naładowane dodatnio (Rutherford nazwał to jądrem atomowym);
- ta masa jest mniej więcej równomiernie rozłożona w obszarze, którego rozmiar jest mniejszy od rozmiaru atomu o rząd wielkości, może dwa, tj. od 0,01Å do 0,1Å;
- W atomie nie może być pustej przestrzeni, inaczej materia atomowa nie stawia oporu ruchowi - wiązka elektronów, podobnie jak wiązka promieniowania rentgenowskiego, swobodnie przechodzi przez dość cienkie obszary materii, np. grubości kilku mikronów.
Jak zajrzeć do wnętrza atomu?
Każdy fizyk dzisiaj powie Ci, że to łatwe. Wystarczy skierować do atomu odpowiednie cząstki, które działają jak ładunki, i zbadać skutki oddziaływania tych ładunków ze składnikami atomu. Aby uniknąć efektu oddziaływania z elektronami, ładunki muszą mieć masę znacznie większą niż masa elektronów. Ale muszą też mieć masę mniejszą niż masa tego, co chcemy badać w atomie.
Aby uniknąć niestabilnego wyniku, ładunki muszą mieć również odpowiednio wysoką energię. W czasach Rutherforda nie było akceleratorów, więc wybór ładunków był niewielki: cząstki α, które odkrył dziesięć lat wcześniej, całkiem dobrze pasowały do tych warunków. Celem (fizycy czasami używają terminu „ekran”) dla cząstek α były atomy złota w cienkiej folii. Rutherford i jego współpracownicy badali inne metale, ale złoto, kowalny i ciągliwy metal, pozwoliło na utworzenie warstwy o grubości do pół mikrometra (0,510-6 m).
Zmierzonym efektem oddziaływania z atomem złota był kąt rozpraszania cząstek α (Rys. 3.).
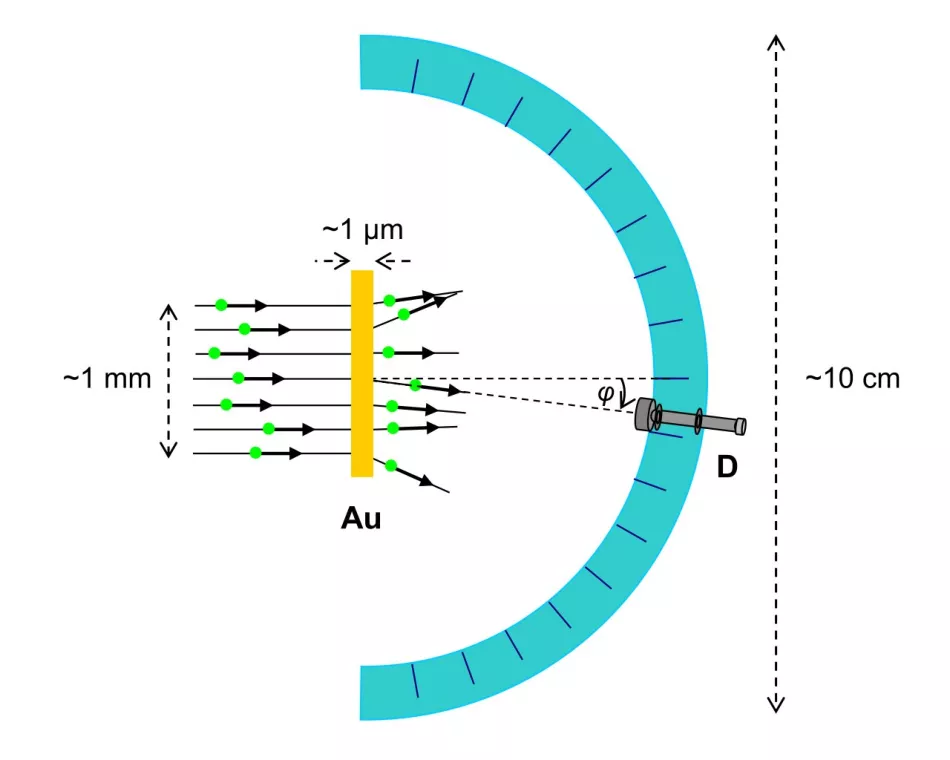 Ryż. 3. Schemat doświadczenia Rutherforda (widok z góry)
Ryż. 3. Schemat doświadczenia Rutherforda (widok z góry)
α-cząsteczki docierają w postaci wiązki o szerokości około milimetra i są rozproszone w metalowej folii o grubości około mikrona. Detektor cząstek α jest umieszczony szeregowo, pod różnymi kątami w stosunku do początkowego kierunku wiązki, na półokrągłej prowadnicy o wielkości około decymetra.
Eksperymentator patrzy w okular i liczy liczbę błysków spowodowanych przez cząstki α rozproszone pod danym kątem w określonym czasie. Czas odniesienia jest taki sam dla wszystkich kątów.
Kąt rozpraszania zależy od kilku czynników:
- dla energii kinetycznej Ek cząstki α,
- na swoim ładunku, qa=+2e,
- na ładunku jądra (złota lub innego pierwiastka użytego w eksperymencie), tj. od liczby atomowej Z tego pierwiastka: Q=+Ze,
- z oszacowanego promienia jądra atomowego Rj,
- na parametr zderzenia b cząstki α z jądrem.
Czego oczekiwano?
Rutherford i inni badali, jak często występuje rozpraszanie pod pewnym kątem φ do pierwotnego kierunku lotu. Zgodnie z ówczesnymi poglądami na temat wielkości jądra atomowego spodziewali się, że kąty te będą mieścić się w ograniczonym, stosunkowo małym zakresie. Maksymalna wartość φmkąta rozproszenia zależy od oszacowanego promienia rji jest osiągana dla każdej z jego wartości przy różnych wartościach parametru uderzenia bmRysunek 4 przedstawia tor cząstki alfa o energii 1 MeV rozproszonej pod maksymalnym kątem, przy założeniu, że Rj=0,01 Å. Tak się złożyło, że cząstka α przechodzi następnie przez małą warstwę jądra.
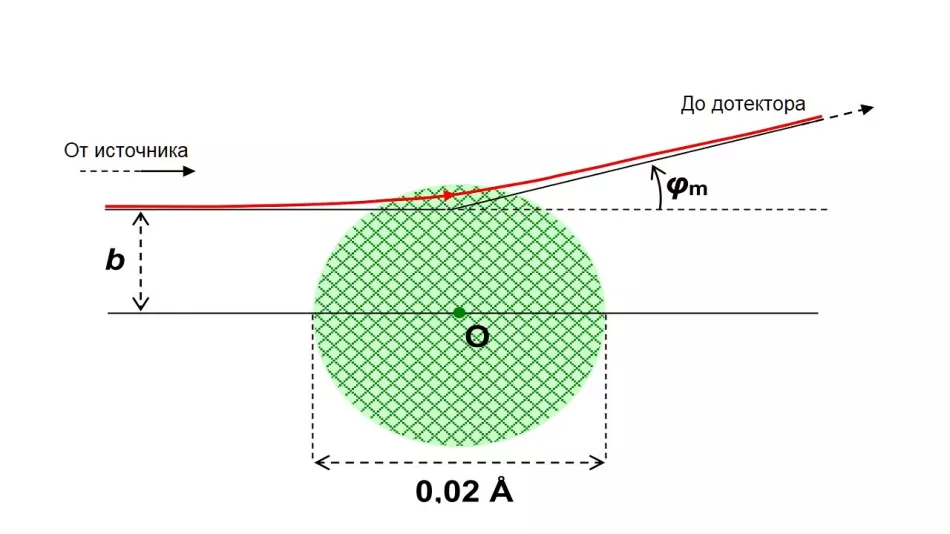 Ryż. 4. Tor cząstki α o energii Ек=1 MeV, rozproszonej podczas interakcji z jądrem atomu złota.
Ryż. 4. Tor cząstki α o energii Ек=1 MeV, rozproszonej podczas interakcji z jądrem atomu złota.
Przyjęto hipotetyczny promień rdzenia Rj=0,01 Å (10-12 m). To o ponad dwa rzędy wielkości więcej niż rzeczywisty promień jądra atomu złota. Na tym obrazku będzie mniejszy niż kropka oznaczająca środek atomu.
Parametr widoczności b ≈ 8-10-13m zapewnia maksymalny kąt rozproszenia φm ≈ 15°.
α cząstki spadające z parametrami większymi niż bmi omijając hipotetyczne jądro zawsze rozpraszają się pod mniejszym kątem - lecą dalej od środka ładunku dodatniego i mniej odchylają się. To samo dotyczy cząstek opadających bliżej kierunku centralnego (b
Wyniki obliczeń kątów φmdla kilku wartości promienia jądra atomowego, wykonanych zgodnie ze znajomością budowy atomu z początku XX wieku wieku przedstawia tabela 1.Warto przypomnieć, że wartości Rj mniejsze niż 0,01 Å dla jądra atomowego nie były wówczas brane pod uwagę.
| Promień jądra atomowego Rj | Maksymalny kąt wiązki φm | Maksymalny kąt z parametrem celowania |
| 0.1 Å | 1.4° | 0.09 Å |
| 0.05 Å | 2.7° | 0,046 Å |
| 0.01 Å | 15° | 0,008 Å |
| 0,005 Å | 37° | 0,003 Å |
Wniosek: znajomość czasu pozwoliła nam uzyskać maksymalne kąty rozpraszania rzędu kilku stopni.
Szok poznawczy eksperymentatora
Zgodnie z oczekiwaniami okazało się, że zdecydowana większość cząstek α jest rozproszona pod małymi kątami, rzędu kilku stopni. Okazało się też – zupełnie wbrew oczekiwaniom – że w niektórych przypadkach cząstki α były rozpraszane pod kątem większym niż 90°, a nawet odbijały się niemal dokładnie z powrotem! Geiger i Marsden przetestowali to wielokrotnie, używając nieco innych konfiguracji eksperymentalnych, zanim zgłosili to Rutherfordowi. Nikt nie spodziewał się takiego wyniku.
Rutherford wielokrotnie wspominał, że był niezwykle zdumiony tym wynikiem. Podczas jednego ze swoich wykładów na Uniwersytecie w Cambridge wypowiedział słynne słowa, których dramaturgii nie oddaje żadne tłumaczenie:
To było najbardziej niesamowite wydarzenie, jakie spotkało mnie w życiu. To było prawie tak niewiarygodne, jakbyś wystrzelił 15-calowy pocisk w kawałek bibuły, a ten wrócił i cię trafił.
Ernest Rutherford
Odkrywczy jest dalszy ciąg powyższego cytatu: „Po chwili namysłu doszedłem do wniosku, że rozrzut pod tym kątem był prawdopodobnie wynikiem pojedynczego zderzenia. Dokonałem odpowiednich obliczeń; przekonali mnie, że możliwe jest tylko jedno wyjaśnienie: atom to układ, którego praktycznie cała masa skupiona jest w mikroskopijnym jądrze, naładowanym dodatnio.”
Oto konkluzja godna fizyka: kiedy dobrze przeprowadzony eksperyment nie zgadza się z wcześniejszymi przekonaniami lub nawet ustaloną teorią, odrzucamy przekonania i przerabiamy teorię.
interpretacja Rutherforda
Użyjmy trzech diagramów pokazanych na rysunkach 5, 6 i 7, aby zobaczyć, co Rutherford zobaczył wewnątrz atomu. Na wszystkich wykresach cząstka α o energii 1 MeV (odpowiada to prędkości prawie 7000 km/s) zbliża się do atomu centralnie – parametr zderzenia jest równy zeru. Zakładamy, że ładunek jądra atomu jest równy ładunkowi złotego jądra - 79 ładunków elementarnych.Siła odpychania elektrostatycznego jądra jest przeciwna do prędkości cząstki α.
Zakładamy, że atom pozostaje nieruchomy i pytamy, czy siła Coulomba może zatrzymać cząstkę α i odesłać ją z powrotem, zanim przejdzie ona przez środek jądra. Jeśli tak, to cząstka α zostanie przyspieszona siłą Coulomba i powróci tam, skąd przybyła, a jej kąt rozproszenia wyniesie 180°. Jeśli nie, to z drugiej strony cząstka α poleci dalej, a kąt rozproszenia będzie równy zeru. Okazuje się, że wielkość jądra atomowego ma tu kluczowe znaczenie.
Rj=0,1 Å, tj. jądro jest 10 razy mniejsze niż atom
Rysunek 5 przedstawia sytuację w skali całego atomu, którego promień wynosi 1 Å. Promień rdzenia wynosi Rj=0,1 Å. Górny wykres przedstawia zależność siły kulombowskiej od odległości do środka jądra. Siła ta osiąga maksymalną wartość nieco poniżej 0,4 mN, gdy cząstka α wchodzi do jądra. Począwszy od tego punktu, siła Coulomba maleje liniowo, osiągając zero w środku jądra.
Zależność prędkości cząstki α od tej samej odległości jest wykreślona na dole diagramu. Ta prędkość maleje, gdy zbliżamy się do krawędzi rdzenia. Po wejściu w rejon rdzenia spadek ten jest mniej wyraźny – odpowiada to spadkowi wartości siły Coulomba. Ogólnie prędkość spadła o mniej niż 2%. Po przejściu przez środek jądra cząstka α przyspiesza, powodując opuszczenie jądra, a następnie całego atomu.
Wniosek: obecność cząstek α o energiach rzędu 1 MeV i wyższych (takich używali Geiger i Marsden), odbijanych wstecz, wyklucza tak duży rozmiar jądra - rzędu 0,1 Å.
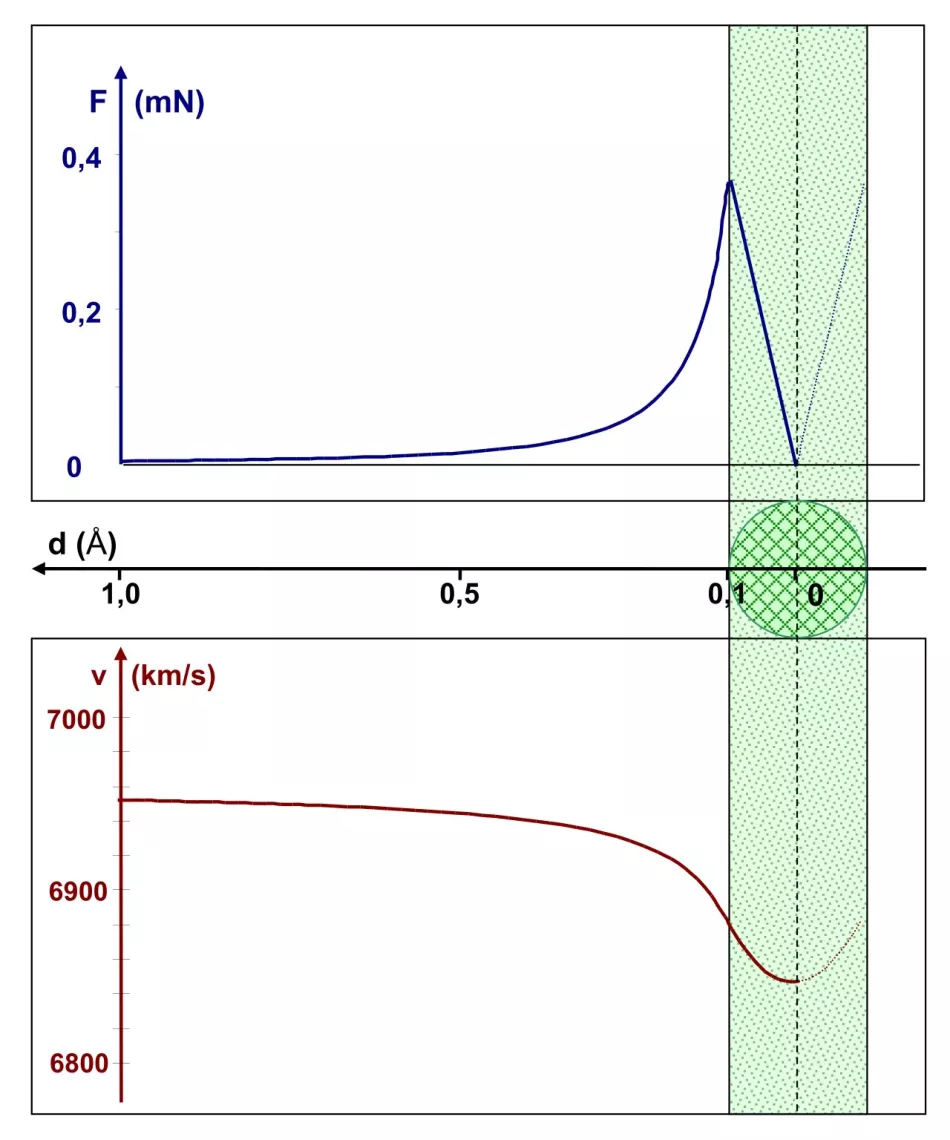 Ryż. Rys. 5. Wykresy siły kulombowskiej i prędkości cząstki α w funkcji odległości d od środka jądra atomowego
Ryż. Rys. 5. Wykresy siły kulombowskiej i prędkości cząstki α w funkcji odległości d od środka jądra atomowego
Oś pozioma wspólna dla obu wykresów znajduje się pomiędzy nimi. Jądro o promieniu 0,1 Å (zaznaczone na zielono) znajduje się po prawej stronie wykresu, więc oś odległości ma nietypowy obrót: w lewo.
Rj=0,01 Å, tj. jądro jest 100 razy mniejsze niż atom
Dlatego w następnej rundzie obliczeń zmniejszmy promień jądra dziesięciokrotnie, do 0,01 Å. Rysunek 6 pokazuje tę sytuację, chociaż nie zawiera już atomu, którego przybliżony promień wynosi 1 Å. Zwróć uwagę na skalę na osi odległości - wykres obejmuje teraz obszar od 0,1 Å do środka jądra. Jego przebieg jest bardzo podobny do poprzedniego. Różnica tkwi w skali. Siła Coulomba na krawędzi mniejszego jądra sięga 40 mN, czyli jest sto razy większa niż przy większym jądrze. Jest to zrozumiałe: stosunek promieni 1:10 oznacza stosunek sił 100:1. Prowadzi to do zmniejszenia prędkości cząstki α o około 18%. Jednak nie zmniejsza się do zera, więc cząstka alfa przechodzi przez środek jądra i przelatuje przez atom.
Wniosek: jądro atomowe musi mieć promień mniejszy niż nawet 0,01 Å, inaczej nie będzie odbijać cząstek α.
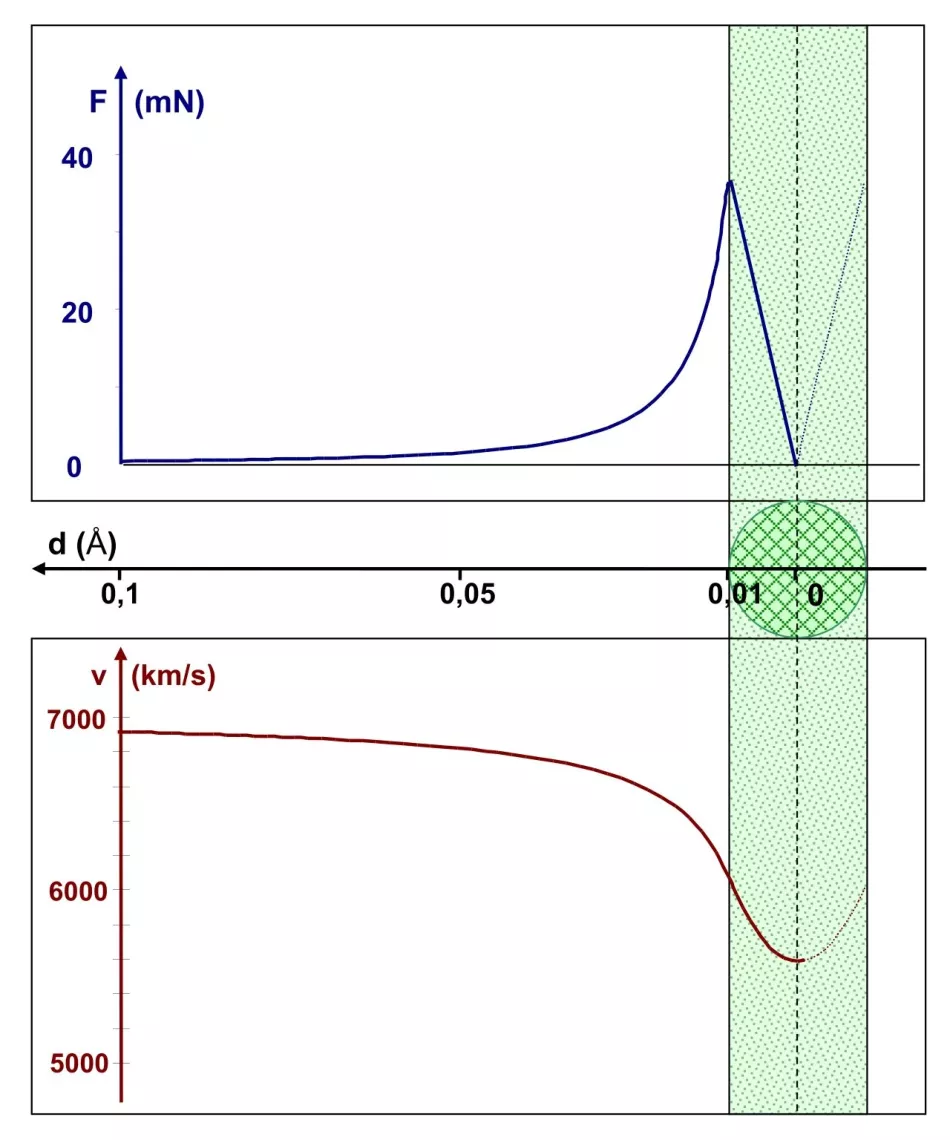 Ryż. Rys. 6. Wykresy zależności siły kulombowskiej i prędkości cząstki α w zależności od odległości d od środka jądra atomowego o promieniu 0,01 Å
Ryż. Rys. 6. Wykresy zależności siły kulombowskiej i prędkości cząstki α w zależności od odległości d od środka jądra atomowego o promieniu 0,01 Å
Maksymalna wartość siły jest sto razy większa niż w przypadku pokazanym na rysunku 5, co pociąga za sobą większy spadek prędkości cząstki α.
Rj=0,001 Å, tj. jądro jest 1000 razy mniejsze niż atom
Zredukujmy jeszcze raz promień rdzenia dziesięciokrotnie - do jednej tysięcznej angstremów - bez zmiany pozostałych parametrów. Zauważamy (Rys. 7.) coś nowego na wykresie prędkości: jej wartość spada do zera, gdy cząstka α znajduje się w odległości około 0,0023 Å od środka jądra, tj. 0,0013 Å od jego krawędzi. W tej pozycji cząstka α została przyspieszona w kierunku, z którego nadeszła – jej kąt rozproszenia wynosi 180°. Warto zauważyć, że siła Coulomba osiągnęła wartość około 700 mN.
Wniosek: jądro atomowe o promieniu 0,001 Å jest w stanie zatrzymać cząstkę α o energii 1 MeV i rozproszyć ją z powrotem. Jest na to nawet pewien „margines”, ponieważ cząstka zatrzymuje się nieco dalej niż 0,001 Å od krawędzi takiego jądra.
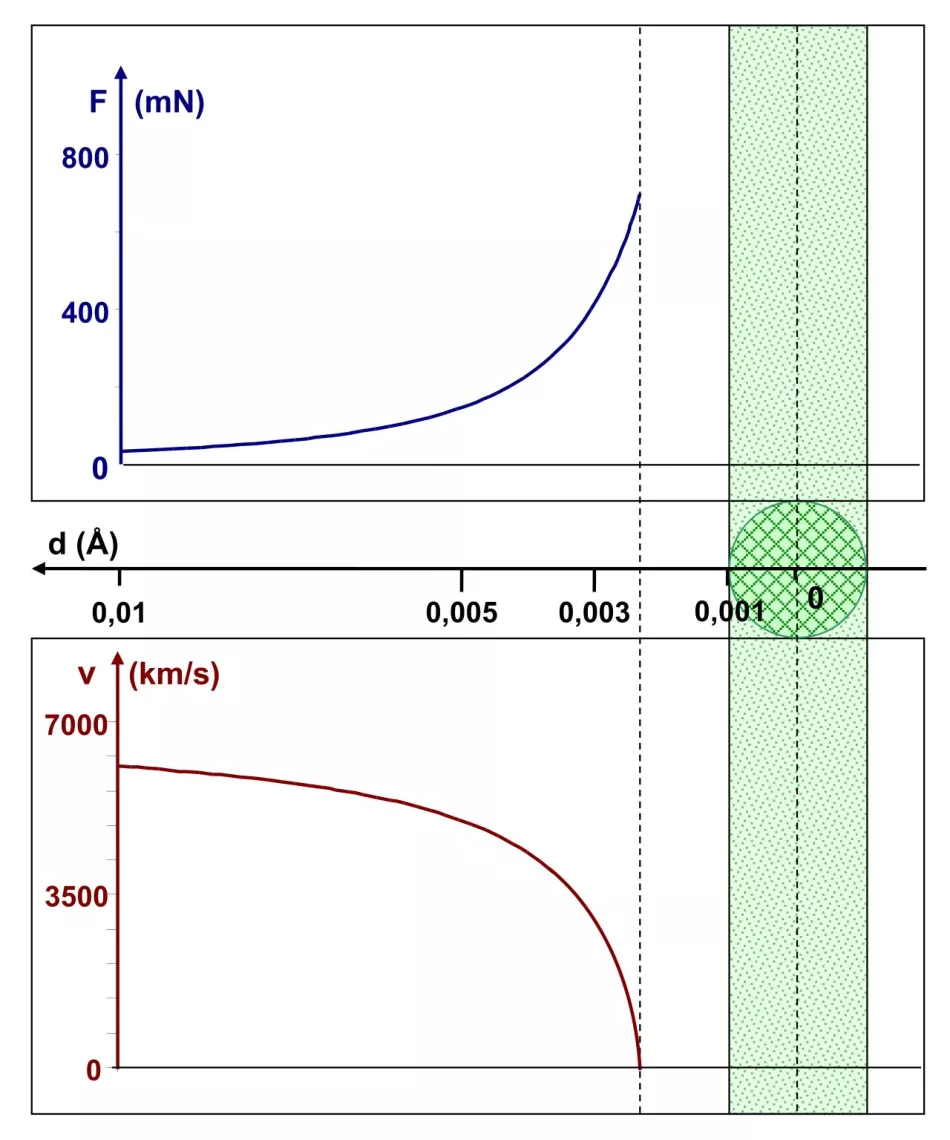 Ryż. Rys. 7. Wykresy zależności siły kulombowskiej i prędkości cząstki α w zależności od odległości d od środka jądra atomowego o promieniu 0,001 Å
Ryż. Rys. 7. Wykresy zależności siły kulombowskiej i prędkości cząstki α w zależności od odległości d od środka jądra atomowego o promieniu 0,001 Å
W odległości około 0,0013 Å od krawędzi cząstka alfa zatrzymuje się i przyspiesza w kierunku, z którego nadeszła.
Zakończenie
Obecność cząstek α o energii 1 MeV, rozproszonych z powrotem, wyklucza promień jądra atomowego większy niż 0,002 Å. Geiger i Marsden wytworzyli cząstki alfa o energiach w zakresie od ponad 1 MeV do około 5 MeV z kilku różnych preparatów radioaktywnych. Wszyscy zostali odepchnięci. Podobne rozumowanie i obliczenia pozwoliły Rutherfordowi wyznaczyć maksymalny możliwy promień jądra atomowego, który wynosi około 0,001 Å.
Dalsze badania budowy atomu przy użyciu różnych cząstek, w tym protonów rozpędzanych w akceleratorach do coraz wyższych energii, umożliwiły zbadanie rozmiarów jąder różnych atomów. Okazało się, że promień rdzenia rośnie wraz ze wzrostem jego liczby masowej A, ale nie osiąga 0,0001 Å, czyli 10-14 m.
Równoległe badania składu atomowego umożliwiły, mniej więcej ćwierć wieku po eksperymentach przeprowadzonych pod kierownictwem Rutherforda i po odkryciu neutronu w 1932 r., określenie składu jąder atomowych różne pierwiastki i ich izotopy.